二甲双胍再立功!BMJ子刊最新研究:“神药”能提高抗肿瘤作用,背后原因找到了
二甲双胍(Metformin)是治疗II型糖尿病的一线药物,可通过抑制肝脏葡萄糖的产生而发挥降糖作用。
早在1957年,二甲双胍便被正式运用于临床治疗糖尿病;在我国也有着超30年的临床应用经验。全球范围内,约有1.5亿人在服用二甲双胍,可谓是目前应用最广泛的口服降糖药之一。
当然,二甲双胍之所以能被“每月一夸”,是因为其远超降低血糖的效果。随着科学的不断推进,对二甲双胍的研究从未停止,现阶段发现的药物作用已超过20种,包括:保护心血管、减少超重/肥胖、改善血脂代谢、降低部分肿瘤风险等等。
近年来,二甲双胍在抗肿瘤领域大放异彩。美国国家癌症研究所官网医学杂志上最新刊登的meta分析,在汇总和分析了166项相关研究后发现:二甲双胍的使用与胃肠道癌症风险降低21%、泌尿系统癌症风险降低12%、血液系统疾病风险降低13%有显著关联。
那么,在肿瘤预防和治疗过程中,二甲双胍究竟是如何发挥作用的呢?
近日,来自芬兰赫尔辛基大学的研究团队揭示了“神药”二甲双胍的免疫调节作用的过程——通过抑制线粒体复合物I,二甲双胍能够促进树突状细胞的成熟,提高它们共同刺激CD4+T细胞的能力,并进一步提升抗肿瘤免疫的能力。

DOI: 10.1136/jitc-2023-008053
虽说癌症的一大共同点是肿瘤免疫微环境(TIME)失调,但真实情况是,肿瘤类型特异性和患者特异性均会影响TIME的实际组成和功能。此外,越来越多的研究显示,TIME能够影响细胞毒性化疗或靶向疗法的结果,因此,在抗肿瘤免疫反应的过程中,确定TIME的特征显得尤为重要。
随着对癌症领域研究的不断深入,抗肿瘤的治疗方式逐渐从单一转为联合。比如:乳腺癌领域,单独通过PD-1/PD-L1通路靶向免疫系统的疗法效果并不好,但同时靶向肿瘤和TIME的紫杉醇+抗-PD-L1组合则被证明是有效的临床疗法。
于是,基于TIME,研究者考虑将细胞毒性化疗或新型抗癌药物与T细胞调节剂相结合,来治疗晚期癌症。
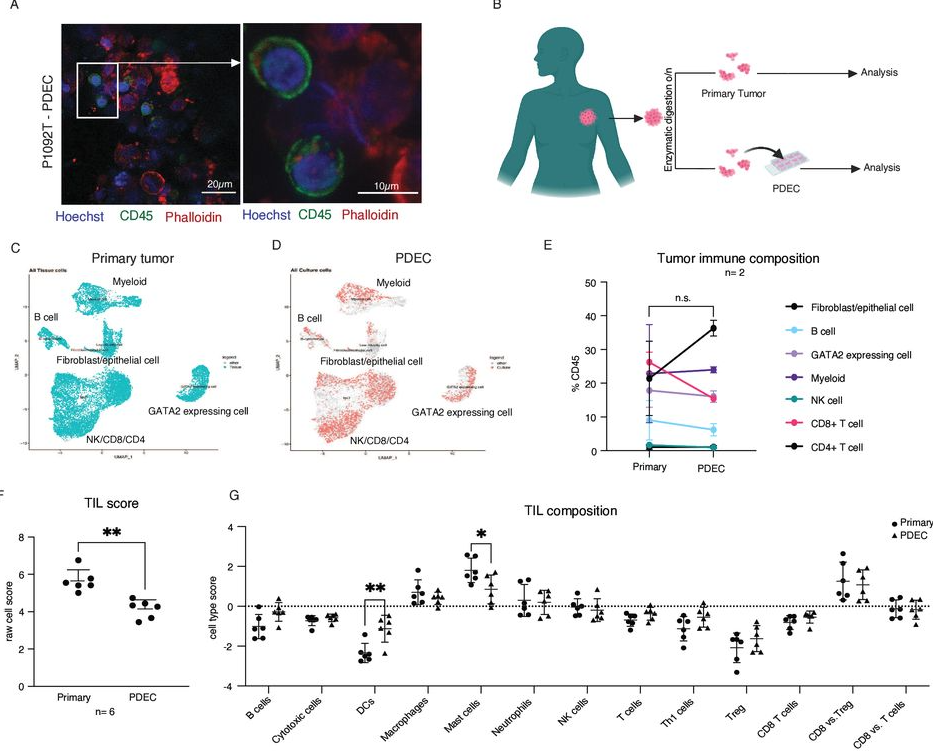
PDECs保留了原发性乳腺肿瘤的免疫背景和基线免疫活性
首先,研究者开发了一种患者来源的外植体培养(PDEC)模型——分析了5名不同患者的PDEC后发现,该模型保留了原发性乳腺肿瘤的免疫环境和基线免疫活性,可作为很好的肿瘤研究模型。
由于PDEC模型保留了TIME,研究进一步探索和验证了肿瘤细胞和TIME对二甲双胍的特异性反应。
通过建立抗原呈递细胞(APC)的标记面板,研究者观察到,使用二甲双胍的治疗后,更多具有树突状细胞(DC)样潜在表型的APC比例明显增加,CD86的水平也有所升高,暗示二甲双胍可能激活了这些细胞。
事实上,DC是一种高效的APC,在体内成熟后可引发强大的抗原特异性T细胞活化。因此,DC的调节对抗肿瘤免疫具有积极的影响,而DC的增加也意味着肿瘤的良好预后。
上述研究表明,在PDEC-TIME中,二甲双胍能够激活APC,促进DC细胞的成熟,但不改变其总数量。而体内研究结果也与PDEC-TIME一致,接受二甲双胍治疗之后,更多的DC被激活;同时,二甲双胍还增加了Irf7、Bst2和Rsad2的表达。
总结来说,无论是体外还是体内,二甲双胍均能促进树突状细胞的成熟。虽然APC的数量没有增加,但更高比例的活化DC也能推动抗肿瘤免疫反应。
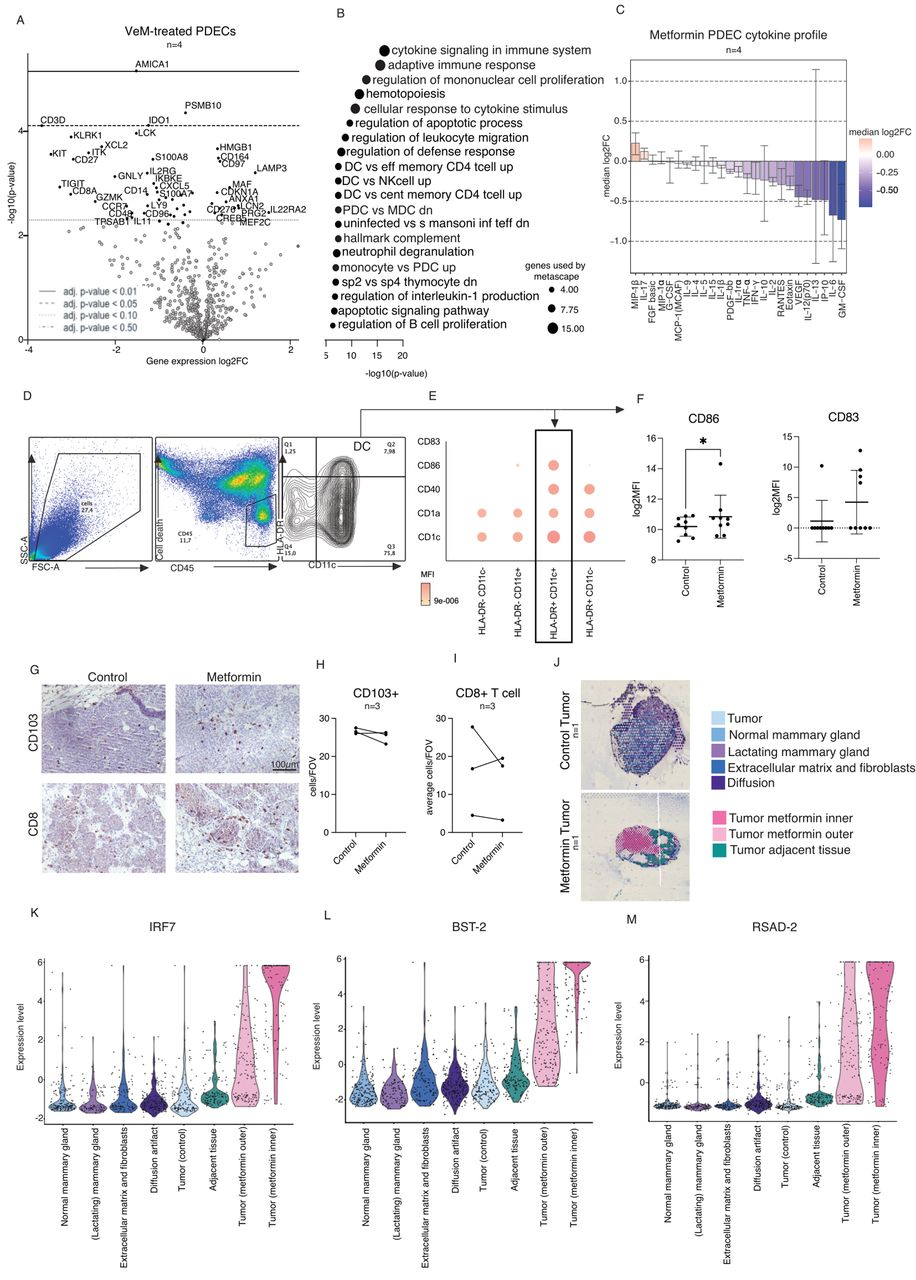
二甲双胍能够促进树突状细胞成熟
那么,这个过程是何如实现的呢?二甲双胍究竟是直接激活还是通过异型细胞细胞相互作用来激活APC的呢?
为了回答这一问题,研究者从健康供体的人外周血单个核细胞(PBMC)中分离出了单核细胞,并将其分化成了巨噬细胞或DC。流式细胞分析显示,二甲双胍诱导了CD86-high和HLA-DR高活化DC比例的增加,提示二甲双胍能够直接促进DC的活化。
事实上,二甲双胍是一种药用双胍,即具有线粒体呼吸链复合物I的弱抑制作用。通过抑制线粒体呼吸链复合物I,二甲双胍能够直接激活DC,促进CD4+T细胞增殖,从而改善抗原特异性免疫反应,实现抗肿瘤的作用。
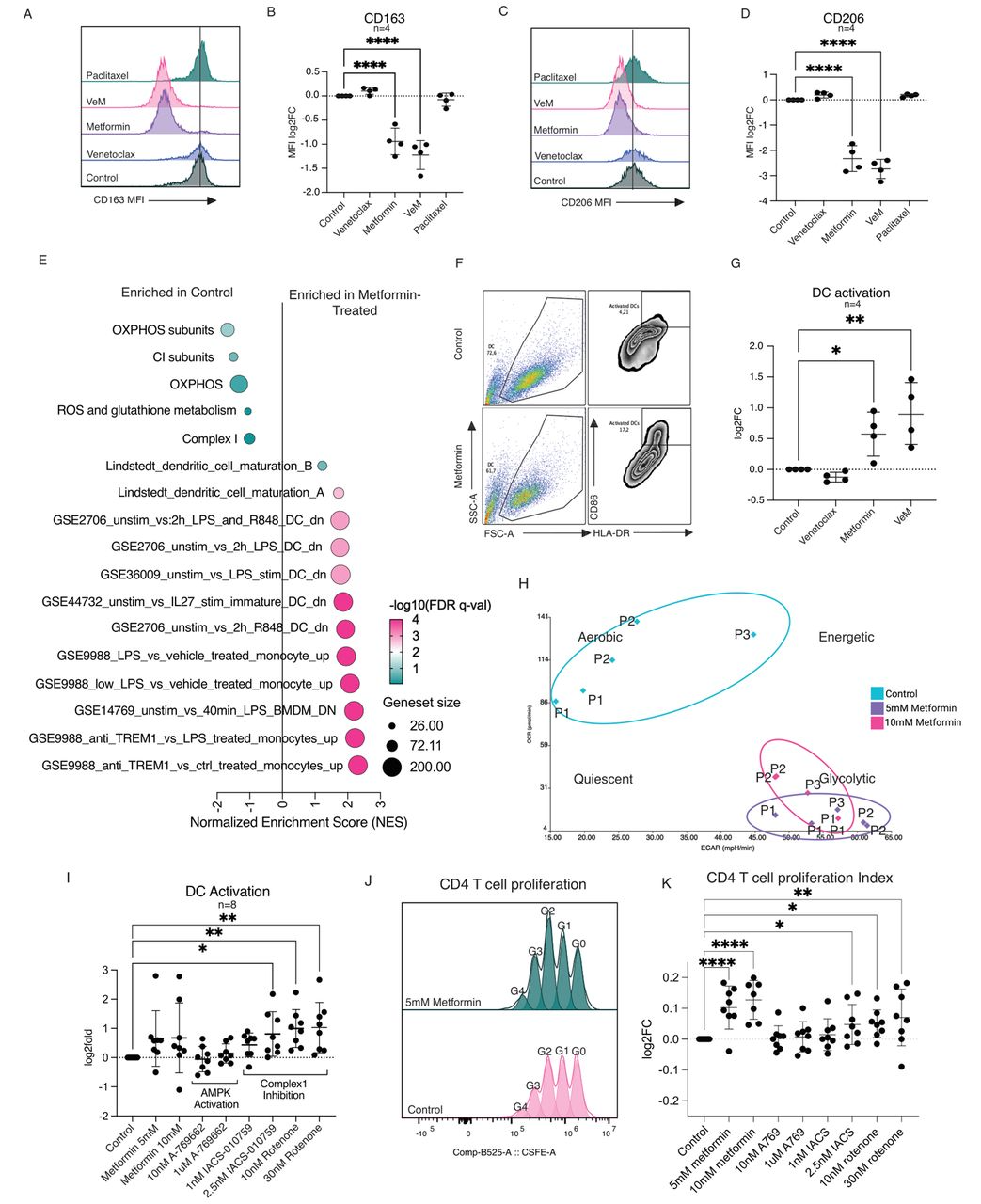
二甲双胍的作用机制
综上,本研究构建了一个多功能临床前免疫肿瘤学模型PDEC-TIME,从而实现更精准的研究。同时,研究也首次揭示了二甲双胍在APC(尤其是DC)成熟和活化中的重要意义,为未来开发基于二甲双胍和激活免疫系统的综合抗癌疗法奠定基础。
二甲双胍啊二甲双胍,你还有多少惊喜是我们不知道的?
即使距二甲双胍首次合成已过去了101年,但科学家仍无法完全阐明其发挥治疗作用的各种领域以及潜在机制,也期待二甲双胍能给我们带来更多的惊喜!
